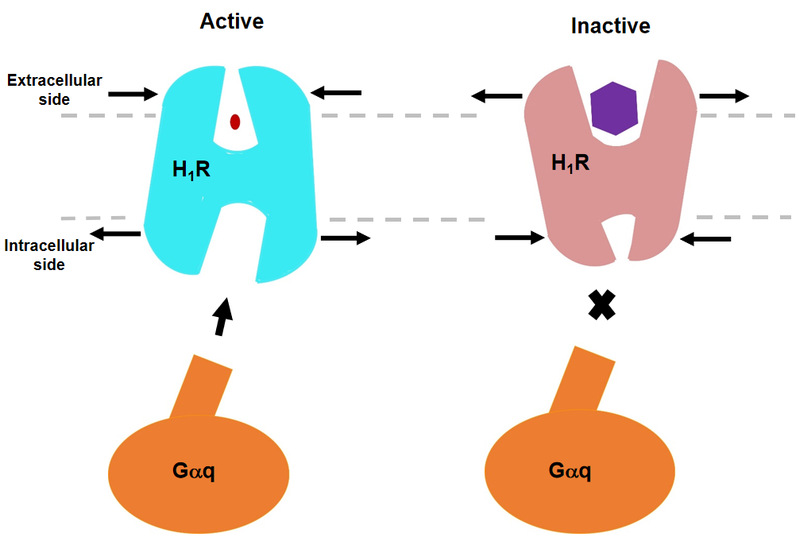
哈工大报讯(生命/文)4月7日,我校生命科学中心何元政课题组在《自然通讯》 ( Nature Communications )上发表论文,首次揭示人组胺受体H1R/Gq复合物冷冻电镜结构。组胺是一种生物胺,通过激活四种已知组胺受体发挥多种生理病理作用。组胺受体分为 H1R、H2R、H3R 和 H4R 四种,属于 A 类 G 蛋白偶联受体 ( GPCR ) 超家族。研究表明,H1R 和 H2R 是治疗过敏和胃酸相关疾病的靶点,而 H3R 和 H4R 在痴呆、哮喘、炎症性肠病和类风湿性关节炎方面有巨大的临床潜力。受体与组胺结合募集异源三聚体 G 蛋白并触发下游信号级联反应。 H1R 主要与 Gq 蛋白偶联激活磷脂酶 C,增加肌醇磷酸盐和细胞内钙水平,H2R 偶联 Gs 蛋白、H3R 和 H4R 通过 Gi/o 蛋白来刺激 cAMP 进行信号传导。
组胺是免疫过敏 ( I型过敏 ) 的关键介质、 H1R介导过敏性疾病的主要诱因。抗组胺药物的开发距今已有半个多世纪的历史,其一直作为过敏性疾病的首选治疗方法。第一代抗组胺药血脑屏障通透性高、受体选择性低,会引起嗜睡、口干等多种副作用。第二代和第三代抗组胺药可显著降低脑通透性,但仍有缺陷,如与受体的低亲和力及心脏毒性。目前,最成功的抗组胺药物设计是带有一个碱性氨基的大分子,这与组胺的咪唑环和乙胺侧链有很大不同,但这些大分子的抗组胺药阻断 H1R 信号的机制仍不清楚。
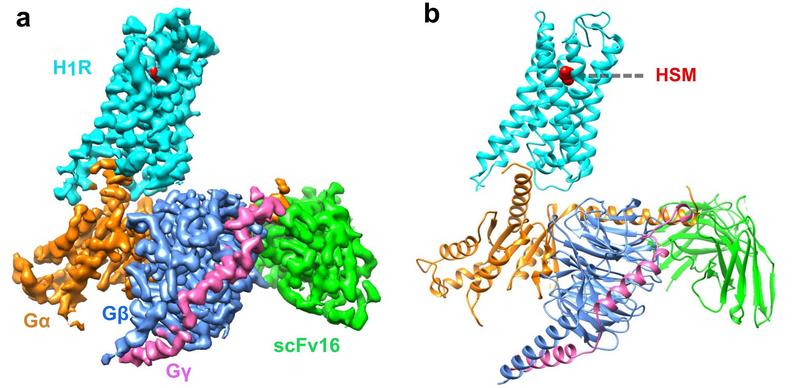
一项早期研究已经揭示了 H1R 与第一代抗组胺药多肽结合的非活性结构,然而,配体诱导受体激活的确切机制仍不明确。该文章通过冷冻电镜展示了人 H1R 与 Gq 蛋白的复合物结构。该结构表明,组胺通过与跨膜结构域 3 ( TM3 ) 和 TM6 的关键残基相互作用激活受体,挤压细胞外侧的结合口袋,打开细胞内侧的空腔,使 Gq 蛋白募集。TM6 的关键残基 Y4316.51 突变为正电荷残基 R 或 K,使其与 TM3 的关键负电荷 D1073.32 相互作用,模拟组胺在结合口袋中将 TM6 拉向 TM3 的作用,使受体获得较高的基础活性。相反,我们发现抗组胺药 ( 反向激动剂 ) 利用其庞大的基团将 TM6 与 TM3 推开,扩大配体结合口袋,形成一种“挤压激活,扩张失活”的模型。与其他受体/G 蛋白复合物的比较揭示了 Gq 偶联的特征,包括胞内环路 2 ( ICL2 ) 和 Gq/11 蛋白 αN-β 之间的相互作用,以及与 G 蛋白结合的 TM7-helix 8 ( H8 ) 的参与。此外,我们还观察到在受体参与时, Gq 蛋白的 αN 有一个大幅度的向外平移运动。结构的详细分析将为理解 G 蛋白偶联选择性提供一个框架,并为设计新的抗组胺药物提供线索。这也是首次报道全长Gq 复合物结构。
何元政课题组实验技术员夏瑞雪,博士生王娜、徐珍媚为并列第一作者,硕士生宋京参与了该课题的研究工作。哈工大冷冻电镜平台工程师张安琪、郭长友合作参与了结构数据的收集工作, 部分数据收集由水木电镜协助完成。何元政研究员为本文的通讯作者。
文章链接:https://www.nature.com/articles/s41467-021-22427-2#MOESM1